かんとこうブログ
2021.06.30
スパイクタンパク結合部位の構造解明
感染が始まって以来、多くの変異株が出現し、そのたびに感染力が強くなったものが優勢種となり世界に蔓延していく印象があります。最近では、インドのデルタ型にさらに変異が起きたデルタプラス型やペルーのラムダ型が話題になっています。このうちデルタプラスは、従来のデルタ型に特徴的なL452Rに、さらにK417N(417番目のアミノ酸がリシンからアスパラギンに変化)が加わったものであり、ラムダ型は、これまで変異の見られなかった490番目のアミノ酸が変異したものであると報道されています。
こうした変異株については、それぞれアミノ酸の変位部位と種類をご紹介してきましたが、やはり構造の変化がわからないと、なぜ感染力が強くなるのかが理解できないと思っていました。この構造についてネットでいろいろ調べて少しわかったことがありますので、今日はそれをご紹介します。最初はデルタ株のヒトの受容体ACE2との結合についてです。本日の時事通信のサイトにデルタ株の結合部位の構造についての図が掲載されていました。この図はカナダのブリティシュコロンビア大学の研究チームが発表したものだそうです。
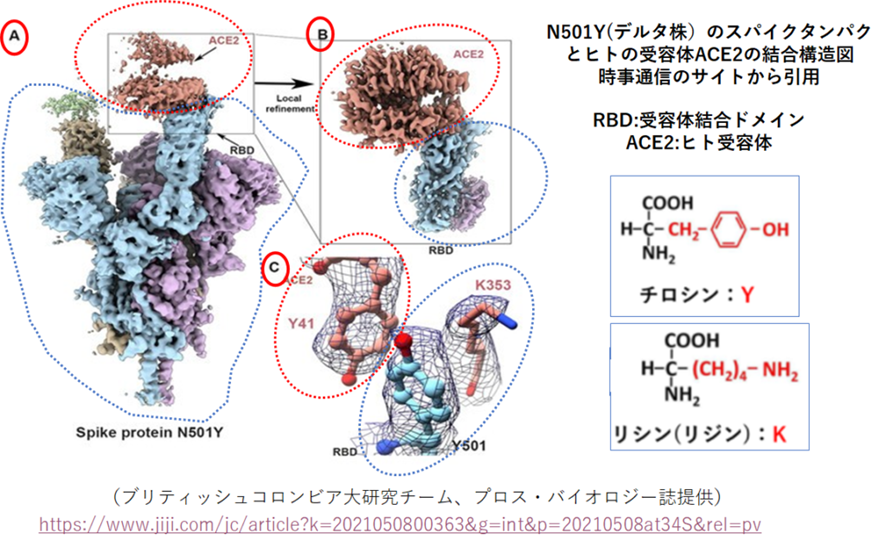 左の図Aから見てください。これはコロナウイルスのスパイクタンパクの結合部位(RBD)とヒトの受容体であるACE2の結合状態を示しています。青い点線で囲ったのがスパイクタンパクの結合部位、赤い点線で囲ったのがヒト受容体ACE2です。B,Cはその結合部位の拡大図です。Cでは、分子構造まで示されていますので、具体的なイメージがわいてくると思いますが、ACE2側はチロシンが、スパイクタンク側同じくチロシンとリシンが結合部位を形成しています。赤い原子は酸素、青い原子は窒素を表しており、水素は省略されています。素人考えでも、結合部位に直接関与している501番目のアミノ酸が変化すれば、結合のしやすさに影響があろうことは容易に想像できます。結合部位に働いている力としては、水素結合力、疎水性相互作用、π-π相互座用などが考えられますが、この図からではもう一つはっきりとはわかりませんでした。
左の図Aから見てください。これはコロナウイルスのスパイクタンパクの結合部位(RBD)とヒトの受容体であるACE2の結合状態を示しています。青い点線で囲ったのがスパイクタンパクの結合部位、赤い点線で囲ったのがヒト受容体ACE2です。B,Cはその結合部位の拡大図です。Cでは、分子構造まで示されていますので、具体的なイメージがわいてくると思いますが、ACE2側はチロシンが、スパイクタンク側同じくチロシンとリシンが結合部位を形成しています。赤い原子は酸素、青い原子は窒素を表しており、水素は省略されています。素人考えでも、結合部位に直接関与している501番目のアミノ酸が変化すれば、結合のしやすさに影響があろうことは容易に想像できます。結合部位に働いている力としては、水素結合力、疎水性相互作用、π-π相互座用などが考えられますが、この図からではもう一つはっきりとはわかりませんでした。
話は横道にそれますが、冒頭のラムダ株については、ほとんどの報道がニューヨーク大学の多田博士のコメントを引用していました。この多田先生はテレビのニュースでインタビューされたときには、各変異株のスパイクタンパクの構造図を持って説明していました。どうやら、すでに出ている変異株についてはアミノ酸配列だけでなく、高次構造まで解明できるようになっているものと推定します。近いうちにデルタプラスやラムダについても、結合部位の構造が解明されることでしょう。
構造についてもうひとつご紹介します。日本の理化学研究所が今年の2月18日に発表した研究のプレスリリースです。これはどんな内容かというと、スパイクタンパクがヒトの受容体にとりつくときに起こすスパイクタンパク自身の構造変化に着目し、どのようなメカニズムで構造変化がおきるのかを解明したものです。コロナウイルスが体内に侵入し、ヒトの受容体と結合する時に起こす構造変化をご覧ください。
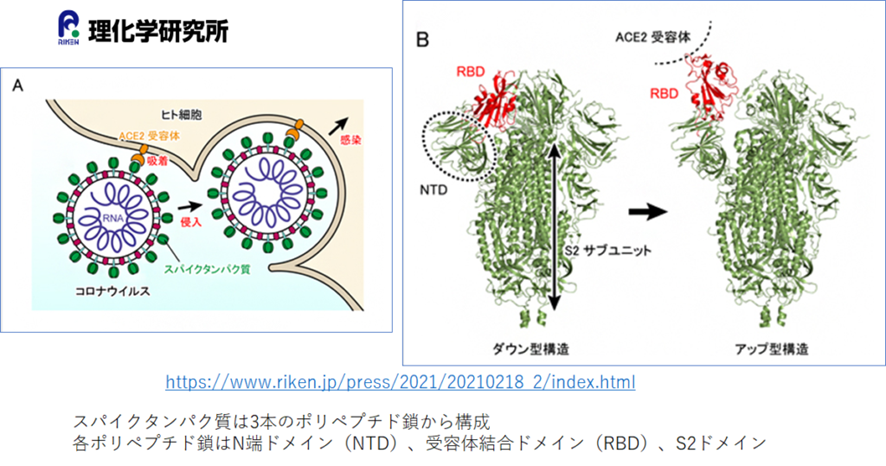
上のAは、コロナウイルスがヒトの細胞に取り込まれる様子です。この時にスパイクタンパクにどのような構造変化がおきているかを示したのがBです。スパイクタンパクは、3本のポリペプチド鎖からなり、それぞれが、N末端ドメイン(NTD)、需要結合ドメイン(RBD)、S2ドメインからなります。
スパイクタンパクは体内では、Bに示すダウン型とアップ型という構造を繰り返しとっていることがわかってきていますが、ヒト受容体ACE2と結合する時にはアップ型構造をとっており結合部位であるRBDが受容体に向かって飛び出すような構造になります。今回の研究ではスーパーコンピューター「富嶽」を用いて、分子動力学シミュレーションを行い、この構造変化には、これらポリペプチド鎖を修飾している糖鎖との相互作用を解析し、構造変化のメカニズムを解明しました。
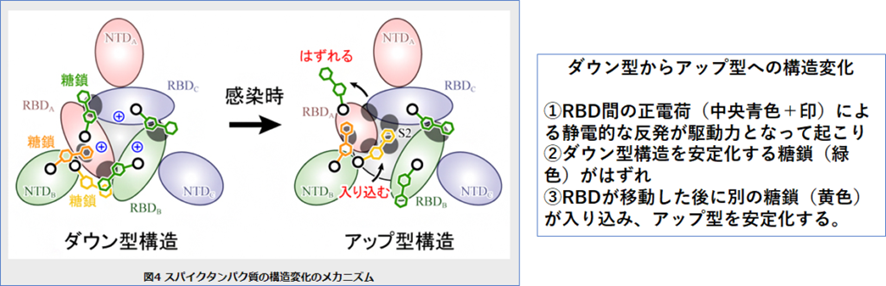
ダウン型から結合時の構造であるアップ型への変化は、①RBD間の正電荷(中央青色+印)による静電的な反発が駆動力となって起こり、②ダウン型構造を安定化する糖鎖(緑色)がはずれ、③RBDが移動した後に別の糖鎖(黄色)が入り込み、アップ型を安定化する。というメカニズムであることがわかりました。
同研究所では、今後の研究について「スパイクタンパク質の構造変化で補強役となる糖鎖に着目し、例えば「ダウン型のRBD-RBD間の糖鎖を外さないようにする」、あるいは「アップ型になる際に入り込む糖鎖を妨害する」といった新たな戦略の創出が期待できます」との可能性を示しています。
構造が分かったからと言ってすぐにコロナ禍が収束するわけではありませんが、こうした地道な努力と成果が、最終的には、コロナの制圧に繋がっていくものと期待しています。